אין טיפול שמרפא סרטן בוודאות, אבל שתי חברות ישראליות מציגות גישות פורצות דרך: האחת מפעילה חום ממוקד להשמדת הגידול, השנייה מפעילה 'טיל מונחה מטרה' ומובילה חומר רדיואקטיבי ישירות לגידול. בשתיהן הרפואה מותאמת אישית ופוגעת רק בגידול ולא באיברים הבריאים
מדי פעם צצות טכנולוגיות המאפשרות טיפולים חדשניים בסרטן ומשנות את כל הגישה הטיפולית. כאלו הן הטכנולוגיות של שתי חברות ישראליות Starget Pharma ו-New Phase: האחת חברת ביוטק והשניה חברת מכשור רפואי, שלמרות הבדלים בגישה ובפיתוח, שותפות לחזון אחד: רפואה מותאמת אישית, חכמה וסלקטיבית, שמסוגלת להילחם במחלה בלי לפגוע באיברים הבריאים.
הראשונה מפתחת טיפול ממוקד שמבוסס על תגובת התאים הסרטניים עצמם; השנייה שולחת חום פנימי לגידול בלי לגעת ברקמות הסובבות. שתיהן כבר בשלבי ניסוי קליני ושתיהן מכוונות רחוק.
כשסיגל קלמנסון קושניר החליטה להקים יחד עם אחיה, רונן קלמנסון, חברה פורצת דרך בתחום הטיפול בסרטן, היא כבר הייתה בעלת רקורד מרשים של עשייה בהייטק: ניסיון עשיר בניהול, תפקידי מפתח בחברות ענק והיכרות עמוקה עם תהליכי פיתוח וחדשנות. לשניהם היה ברור מראש שהחברה שהם ייסדו תעמוד על התפר שבין מדע מתקדם, טכנולוגיה רפואית ובינה מלאכותית.
במשך שנה שלמה הם סרקו את הארץ בחיפוש אחר טכנולוגיה בשלה שיכולה לחולל מהפכה אמיתית ונפגשו עם מיטב החוקרים מהטכניון, מכון ויצמן, בתי חולים ואוניברסיטאות. כשהגיעו לשיבא ופגשו צוות שפיתח במשך 15 שנה מולקולות פפטידיות היכולות להוביל חומרים רדיואקטיביים ישירות לתאים הסרטניים, הם הבינו שמצאו את מה שחיפשו והקימו את Starget Pharma, חברה שנועדה לממש את הפוטנציאל לפיתוח טיפולים חדשניים, מדויקים ובטוחים יותר במחלת הסרטן.
באחת מהשיטות החדשניות בתחום, שנקראת תרנוסטיקה, המטופל מקבל תחילה מנה של חומר רדיואקטיבי חלש, שנועד להדמיה בלבד – מעין סריקה ביולוגית שמאפשרת לוודא שהמולקולה אכן מגיעה לתאים הסרטניים. רק אם יש קליטה טובה, ממשיכים לשלב הטיפול, בו מוחדר אותו רכיב מולקולרי עם איזוטופ חזק שמסוגל להשמיד את הגידול.
כדי לעשות זאת, פיתחה החברה את מה שקלמנסון קושניר מכנה "הפלטפורמה הטכנולוגית הראשונה בעולם להנדסת מולקולות רדיואקטיביות בהובלת בינה מלאכותית": "המערכת שלנו מזהה קולטנים ייחודיים בתאים הסרטניים ומתאימה להם מולקולות חכמות שיודעות להתחבר בדיוק למטרה, מבלי להתפרק בדרך", היא מסבירה. "זה דורש שילוב בין כימיה, הנדסה, רפואה גרעינית, ביולוגיה חישובית ואונקולוגיה – והכול בקצב פיתוח שמאפשר ריצה קדימה."
הפלטפורמה של Starget לוקחת את הקונספט החדשני של טיפול ממוקד צעד אחד קדימה. בשלב הראשון, המטופל מקבל חומר להדמיה בלבד, שאינו מסוכן, ומוודאת שהחומר מגיע באופן מדויק לתאים הסרטניים. "רק אם אנחנו רואים שהחומר נקלט בתאים הסרטניים בהדמיה, המטופל יקבל את הטיפול עצמו", מסבירה קלמנסון קושניר. "זה משנה לחלוטין את הגישה הטיפולית, כי במקום להמר אם הטיפול יעיל ועשוי לעזור, אנחנו יודעים מראש באופן ודאי אם הטיפול אכן מתאים למטופל הספציפי. המשמעות היא חיסכון אדיר בעלויות ובזמן והגברה דרמטית של סיכויי ההצלחה.
"החזון שלנו מבוסס על יצירת טיפולים חכמים שמביאים את החומר הפעיל בדיוק לאן שצריך", אומרת קלמנסון קושניר. "פיתחנו פלטפורמה פורצת דרך, שמובילה חומרים רדיואקטיביים ישירות לתאים סרטניים, מצמצמת דרמטית את תופעות הלוואי ומבטיחה שהטיפול יינתן רק למי שיכול להפיק ממנו תועלת אמיתית. אנחנו קוראים לזה 'טיל מונחה מטרה' – המולקולה נושאת חומר רדיואקטיבי ישירות אל התא הסרטני ואליו בלבד. כך הטיפול הופך ממוקד, מדויק ובטוח בהרבה בהשוואה לשיטות המסורתיות כמו כימותרפיה או הקרנות".
קלמנסון קושניר טוענת כי מדובר ב"רפואה מותאמת אישית על סטרואידים", שמבטיחה טיפול אפקטיבי, בטוח ויעיל יותר לחולים. עם זאת, היא מציינת את האתגרים והסיכונים שהטיפול הרדיואקטיבי טומן בחובו: למרות שהטיפול מצמצם מאוד את הסיכון לפגיעה באיברים בריאים, נדרשת זהירות קפדנית במינונים המדויקים, שכן עדיין קיימת אפשרות לפגיעה קלה בכליות או לתופעות לוואי אחרות, אף שהן מינימליות בהשוואה לכימותרפיה או הקרנות מסורתיות.
הפלטפורמה החדשנית של Starget מבוססת על שילוב טכנולוגיות מורכב המאפשר לחברה לפתח במהירות וביעילות מולקולות חדשות, מותאמות אישית לסוגים שונים של סרטן. "הפוטנציאל העסקי עצום והפלטפורמה יכולה להוות בסיס לשיתופי פעולה רבים עם חברות פארמה גלובליות, במטרה לפתח מגוון רחב של תרופות ממוקדות לסוגי סרטן שונים", אומרת קלמנסון קושניר.
החברה צפויה להתחיל בניסויים קליניים מתקדמים בשיתוף עם MD Anderson – מרכז אונקולוגי מהמובילים בעולם. "הניסוי הקליני שלנו כולל 80 חולים המתמודדים עם סוגי סרטן מאתגרים כמו סרקומה, סרטן כבד, סרטן עור וסרטן נוירואנדוקריני", אומרת קלמנסון קושניר. בשנה הקרובה, מתוכננים ניסויים נוספים בתרופות לסרטן השד, הערמונית והריאות.
קלמנסון קושניר מייחסת חשיבות רבה לשיתוף הפעולה עם רשות החדשנות. "אנחנו שואפים להיות חברה כחול-לבן שפורצת דרך בתחום המאוד מבטיח אך גם מאוד מורכב של הביוקונברג'נס, הדורש אינטגרציה של עולמות. הרשות מהווה כאן גורם משמעותי לא רק בהשקעות אלא גם בכך שהיא מאפשרת לנו ליצור שיתופי פעולה משמעותיים, לפתח תשתיות חיוניות ולקדם טכנולוגיות שישנו את המציאות".
קלמנסון קושניר מייחסת חשיבות רבה גם להרכב האנושי של עובדי החברה. רוב המנהלות בחברה הן נשים, והצוות מתאפיין בשילוב יוצא דופן של מדענים וחוקרים מתחומים שונים, מכימיה, פרמקולוגיה וביולוגיה דרך רפואה גרעינית, הנדסת תוכנה ובינה מלאכותית, בטווח גילאים רחב. "יש לנו מדענים בכירים עם 40 שנות ניסיון בפיתוח תרופות שעובדים לצד חוקרים צעירים בני 25 שזה עתה סיימו את הדוקטורט שלהם", היא מספרת בגאווה. "אני מאמינה שהשילוב בין הניסיון והחכמה של המדענים המנוסים, יחד עם החדשנות והרעננות של החוקרים הצעירים, הוא חלק משמעותי מהיכולת לפרוץ דרכים חדשות ולהתמודד עם אתגרים מורכבים".
“טכנולוגיות משבשות, מהסוג המופיע אחת לדור, מעצבות מחדש את הדרך שבה אנחנו מפתחים, מטפלים ומגיבים לעולם סביבנו. עתיד הרפואה המותאמת אישית מבוסס על השילוב בין ביולוגיה, הנדסה ובינה מלאכותית. שילוב זה פותח אפיקים חדשים ברפואה ומגדיר מחדש איך נראית מערכת בריאות מודרנית."
ד"ר אלון סטופל, יו"ר רשות החדשנות
מוצאים את הדרך להכות בסרטן
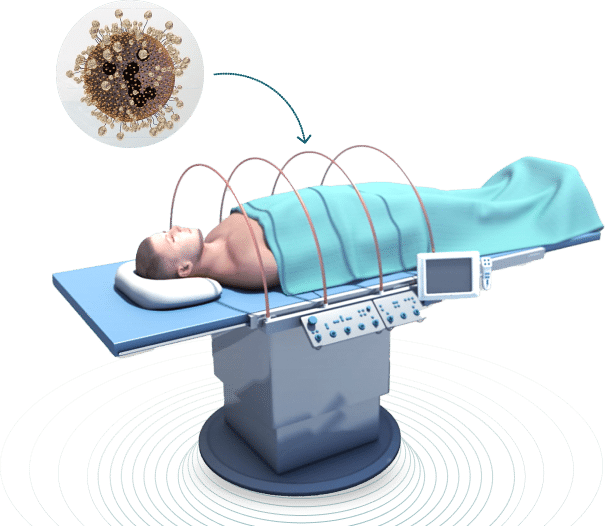
New Phase היא חברת דיפ-טק ישראלית שפיתחה טכנולוגיה פורצת דרך להשמדת גידולים סרטניים באמצעות היפרתרמיה מגנטית. הטיפול מבוסס על הזרקת ננו-חלקיקים מגנטיים, שמצטברים בגידולים ומחוממים בתוך הגוף לטמפרטורה של 50 מעלות על ידי שדה אלקטרומגנטי חיצוני, לשם הרס ממוקד וסלקטיבי של תאים סרטניים, מבלי לפגוע ברקמות הבריאות. טכנולוגיה מדויקת, שמתמודדת עם נקודות התורפה של הסרטן ומשנה מציאות.
החברה פועלת כיום בשלב הקליני הראשון, בשיתוף בתי חולים בישראל ובארצות הברית, וזוכה לעניין גובר מצד ה-FDA ובתי חולים מובילים בעולם.
עופר שלו, מנכ"ל ומייסד-שותף, הקים את New Phase יחד עם ד"ר רפאל חוף בשנת 2013, לאחר התמודדות אישית של ד"ר חוף עם מחלת סרטן הריאות של אמו. "זה היה הטריגר לחשוב אחרת", הוא מספר. "חיפשנו פתרון שונה – לא עוד ניסיון להמציא ביולוגיה חדשה, אלא להבין את החולשות של התא הסרטני ולהרוס אותו באמצעים פיזיקליים בעזרת רגישות התא הסרטני לטמפרטורה מעל 45 מעלות. לראות כיום את החולים שאנחנו כבר מצליחים לטפל בהם. זו הגשמת חלום".
שלו, שכבר הוביל חברות אחרות בתחום מדעי החיים, מדגיש שהגישה של New Phase נשענת על שתי הנחות יסוד: הראשונה – אין כיום פתרון מוחלט למחלת הסרטן ולכן חשוב היה לפתח כלי שיאפשר את ניהול המחלה, כלומר מניעת התפשטותה. השנייה – יש לעשות זאת ללא תופעות הלוואי הקשות של הטיפולים הקיימים ובדרך שתעקוף את בעיית העמידות של הגידול לתרופות ואכן המטופלים שמשתתפים בניסוי הצטרפו לאחר שמיצו את הטכנולוגיות הקיימות.
"במקום לפתח תרופה חדשה, הלכנו אל הפיזיקה מתוך הבנה שהנחות עבודה שמבוססות על פיזיקה עובדות", הוא מסביר. "תא סרטני הרבה יותר רגיש לחום מתאים בריאים, אין לו מערכת פינוי חום כמו לתאים בריאים, והממברנה שלו לא יכולה לפתח עמידות לחום, בניגוד לתגובה של התא הסרטני מול תרופות. כך נולד הקונספט: נייצר חום מדויק בתוך הגוף, שייפגע בתאים הסרטניים בלבד, ונשמיד אותם מבלי לפגוע ברקמות הבריאות".
הטכנולוגיה שפיתחו בניו פייז מבוססת על היפרתרמיה אלקטרומגנטית באמצעות ננו-חלקיקים סופר-פרמגנטיים. מדובר בחלקיקים זעירים המכילים תחמוצת ברזל, מצופים בפולימר ביוקומפטבילי, שמוזרקים לזרם הדם ומנצלים תכונות ביולוגיות ייחודיות של תאים סרטניים כדי להצטבר דווקא שם. "לתאי סרטן יש מבנה כלי דם שונה, דולף יותר, ומערכת לימפה פחות יעילה, שלא מצליחה לפנות את החלקיקים. כך שהצטברות בגידולים היא כמעט ודאית", מסביר שלו.
לאחר ההזרקה מקרינים את הגוף בשדה מגנטי מתחלף, שאינו מיינן, אך חודר לעומק הגוף. הקרינה מחממת את הננו-חלקיקים שהצטברו בתאים הסרטניים, ומכאן מתחילה פעולת הפיזיקה העדינה.
החלקיקים מתוכננים כך שהם לא יכולים להתחמם מעל ל-50 מעלות צלזיוס. תופעת החום הכמוס מאפשרת להם לספוח אנרגיה מבלי להעלות טמפרטורה. למה זה חשוב? כי תאים סרטניים נהרסים בטווח של 45-41 מעלות. תאים בריאים, לעומת זאת, מחזיקים מעמד גם ב-55 מעלות. המשמעות היא שהגידול בלבד נפגע, בעוד שהרקמה הבריאה נשארת שלמה".
הגישה הזו אפשרה ל-New Phase להירשם כטכנולוגיה רפואית (Medical Device) ולא כתרופה – עניין מהותי בכל הקשור לניסויים קליניים, משך הפיתוח ועלויות. "היה לנו ברור שלמסלול של תרופה נצטרך מאות מיליוני דולרים, שזה לא ריאלי. כטכנולוגיה, אנחנו מדברים על סדרי גודל של עשרות מיליונים, וזה אפשרי", אומר שלו.
הטכנולוגיה שפיתחו מאפשרת להגיע גם לרקמות עמוקות בגוף – אזור הבטן, הכבד, הריאות, ולחמם רק את הנקודות שדורשות טיפול באופן ממוקד וללא פגיעה מערכתית. "אנחנו לא זקוקים להקרנות או כימותרפיה שפוגעות במערכות הבריאות בגוף. רק לחלקיקים שכבר הגיעו לתאים הסרטניים – ואת זה אנחנו עושים", מדגיש שלו
אחת החוזקות הבולטות של הטכנולוגיה היא הסלקטיביות הגבוהה שלה. "החלקיקים שאנחנו מזריקים נעים דרך זרם הדם", מסביר שלו. "אבל במקומות שאין בהם גידולים, הם פשוט ממשיכים לזרום ולא חודרים לרקמות. יש הצטברות בכבד ובטחול, שדרכם גם מפונים החלקיקים מהגוף, אך ההצטברות היא זמנית ובאיברים אלה יש גם פינוי חום יעיל ולכן אין פגיעה בהם".
הננו-חלקיקים עצמם יציבים מאוד, לדבריו. הם לא מתפרקים בגוף, לא מהחום, לא מהקרינה וגם לא כתוצאה מחשיפה לאנזימים או נוזלי גוף. הם יוצאים מהגוף באופן טבעי. הטיפול עצמו עורך כחצי שעה בלבד. תופעת הלוואי היחידה שתועדה עד כה היא תחושת חום רגעית בגב התחתון – תופעה שצוות החברה חזה מראש ונעלמת בתוך דקות.
עדיין לומדים את השפה החדשה
עד היום, נוסתה הטכנולוגיה בהצלחה במאות עכברים וחזירים, וכבר טופלו באמצעותה 24 מטופלים שחלו בתשעה סוגים שונים של סרטן. "לא נרשמה רעילות ובחלק מהמקרים המחלה הוגדרה כיציבה ולא זוהו גרורות חדשות", אומר שלו. "נכון, עדיין אין לנו דאטה סטטיסטי מובהק – הקבוצות קטנות, רק כמה חולים בכל מחלה – אבל הכיוון מעודד ויאפשר לנו להתמקד בניסוי פאזה שנייה עם מספר מחלות מוגדר ".
ל-New Phase יש כיום אישור רגולטורי לטפל בחולי סרטן שלב 4 – חולים שמיצו את כל אפשרויות הטיפול האחרות ונמצאים במצב שאין בו תקווה טיפולית קונבנציונלית. "זה קהל יעד מאוד מורכב", מדגיש שלו, "ובדיוק בגלל זה היה לנו חשוב לפתח פתרון שיאפשר איכות חיים לצד הארכת חיים ובלי תופעות לוואי".
אמנם ישנם טיפולים נוספים בעולם שמתבססים על חימום, אך רובם דורשים זיהוי מדויק של הגידול באמצעות MRI או CT ואז חימום נקודתי באמצעות אולטרסאונד ממוקד או RF. "זה עובד כשאפשר לראות את הגידול", אומר שלו, "אבל מה אם הגידול קטן מדי מתחת לגודל הזיהוי? בטכנולוגיות אלו אי אפשר להשתמש בטיפול סיסטמי בשלב הגרורתי.
כאן נכנסת לתמונה הגישה המערכתית של New Phase: החלקיקים מוזרקים לדם, מגיעים לגידולים בעזרת תופעת הדלף, מתחממים תחת השדה האלקטרומגנטי לטמפרטורה מבוקרת של 50 מעלות, שהורגת רק גידולים סרטניים שמטבעם רגישים לחום.
"פריצת הדרך בטיפול הסיסטמי היא שאנחנו לא צריכים לדעת איפה בדיוק הגידול נמצא", אומר שלו. "אנחנו פשוט מחממים את אזור הטורסו של המטופל, בלי לכוון את השדה האלקטרומגנטי לגידול ספציפי אלא לאזור בו נמצאות הגרורות".
במהלך חצי השנה הקרובה מתכננת החברה לצמצם את ההתמקדות לשלושה-ארבעה סוגי סרטן ולבצע ניסוי רחב יותר, בחלקו בישראל ובחלקו בארצות הברית. " בקרוב נתחיל עם בתי חולים בארצות הברית, ונבדוק קבוצות של 20-15 חולים בכל סוג סרטן. כבר היום יש מטופלים שעברו שישה-שבעה טיפולים והמחלה נותרה מיוצבת ובלי תופעות לוואי".
לצד האופטימיות הקלינית, יש גם ביקורת על המציאות המקומית. "רשות החדשנות ליוותה אותנו, וזה חשוב – אבל זה לא מספיק", אומר שלו בכנות: "אין כלים לתמוך בחברות שנמצאות בשלבים מתקדמים. קרנות הון הסיכון הישראליות אינן נמצאות בתחום הרפואה, למרות כל המילים הגבוהות. כל מה שנמצא אצלם על השולחן הוא תוכנה ו-Digital Health ומעט מאוד השקעות בחברות שנמצאות בניסויים קליניים. תחום הפיתוח התרופתי והטכנולוגיות הרפואיות פשוט נזנח. ההשקעות בדיפ-טק לא מספיקות ומהרבה שיחות עם גופי ההשקעה בחו"ל, הפיכת החברה הישראלית לחברה אמריקאית היא הגישה הנכונה של החברות להתפתח.
הטכנולוגיה של New Phase חדשנית לגמרי, ועל כן דורשת גם ניסוי והוכחה, וגם תהליך של למידה מתמשכת מצד כל הגורמים במערכת. "מדובר בטכנולוגיה שלא הייתה קיימת קודם, ולכן טבעי שבשלב הזה, במיוחד בפאזה ראשונה, גם הרגולטור וגם הצוותים הרפואיים עדיין לומדים את השפה שלה", אומר שלו. "יש מעט מאוד ניסויים קליניים מהסוג הזה, אז גם ברמה הבינלאומית יש פחות ידע מצטבר". הדבר בא לידי ביטוי גם במספר המאמרים המדעיים שהחברה פרסמה עד היום.
בחברה מועסקים כיום 23 עובדים מתחומים שונים – כימיה, ביולוגיה, פיזיקה והנדסה ובאיזון מגדרי ומגזרי. תפיסת ההכלה והגיוון היא חלק מהחזון הרפואי. "מה שמחזיק את האנשים שלנו זו ההתלהבות", הוא אומר. "בהתחלה זו הייתה טכנולוגיה מרגשת. היום, המפגש עם החולים והניסויים הקליניים הוא מה שנותן את הדרייב".
